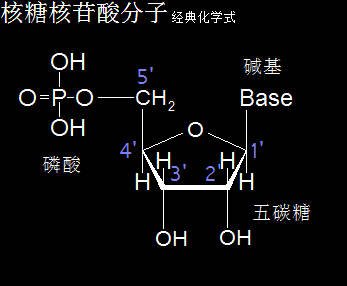
核糖核苷酸分子的化学式,是由一分子磷酸、一分子核糖(一种五碳糖)、一分子含氮碱基构成。核糖核苷酸分成腺嘌呤核糖核苷酸、鸟嘌呤核糖核苷酸、胞嘧啶核糖核苷酸、尿嘧啶核糖核苷酸。核糖核苷酸分子是生命遗传物质RNA的主要成分,一般存在于细胞质中,包括了核糖体中的tRNA和rRNA、线粒体和叶绿体中的遗传物质RNA、细胞质和细胞核中的mRNA。
现代生命科学之所以对基因遗传的机制不清楚,就在于对这三种分子形态的结构认识不足所致,根源在于错误的经典原子结构模型。这里用原子以太旋涡模型粗略解析这三种分子的波流一体形态,以让人们对核糖核苷酸分子结构有一个全新的认识。
1、水合磷酸分子
核糖核苷酸,主体是磷酸分子与五碳核糖分子,尤以磷酸分子为重。磷酸分子的核心是磷元素原子以太旋涡,在元素周期表中原子量排在15,比碳氮氧三种元素的原子量6、7、8大一倍左右,可以判定其振动力场与流动力场的作用半径比碳氮氧三种元素原子以太旋涡也要大上一倍以上。如此相对大原子量,让磷酸分子以太旋涡在核糖核苷酸分子中起主导作用,并让核糖核苷酸分子构成的高分子运动形态展现磷元素原子以太旋涡的特征。
磷酸分子的经典化学分子式是H3PO4,具有酸的通性,是三元弱酸。以太旋涡理论里,磷酸分子是以磷元素原子以太旋涡P为核心,OH、O为周边环绕的次生以太旋涡结构形态,分子式为(PO)·(OH)3,即先一个P与一个O通过同旋异极吸附作用耦合成(PO),及三个O与三个H耦合成(OH),再三个(OH)与一个(PO)通过异旋同极吸附作用耦合在一起,整体构成磷酸分子次生以太旋涡。
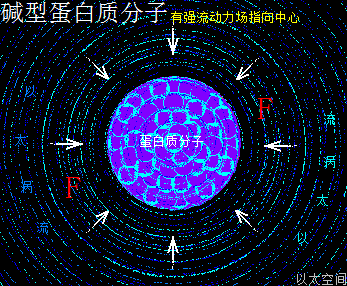
细胞器的活动场所主体是水溶液环境,虽然磷酸分子的分子式是H3PO4,但由于处在水溶液环境中,于是磷原子以太旋涡的强振动力场,会导致水分子H2O分解成游离态的H+与HO-两种离子以太旋涡,并分别被磷酸分子上的磷原子与氧原子捕获而形成耦合态结构,如此结构就是水合磷酸分子H3PO4·H2O,又简写作H5PO5。也即磷酸处于水溶液中与处于浓缩态及结晶态是不一样的以太旋涡结构形态,而非人们通常以为的有水无水环境下都还是原分子式结构。
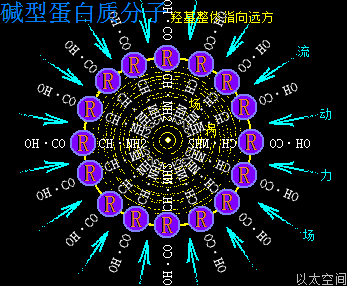
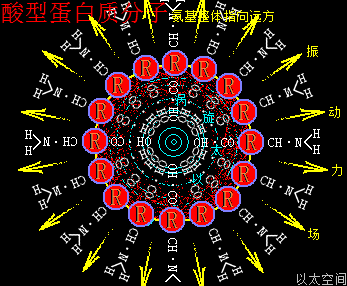
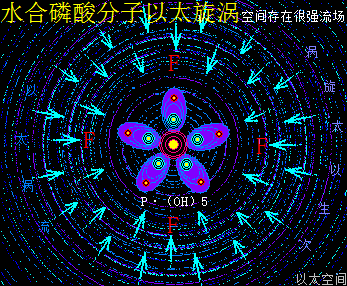
细胞中的磷酸分子是以水合物形式存在,因此这里专门介绍H5PO5的以太旋涡下耦合结构模式。水合磷酸分子H5PO5的详细分子式是P·(OH)5,是磷酸分子(PO)·(OH)3在水合过程中,(PO)离子上的O原子以太旋涡捕获水分子解体时的H+形成(OH),因其振动力场提高,(PO)中的O原子与P原子的耦合结构被破坏,即共价键断开而相互远离,同时磷原子以太旋涡的流动力场捕获OH-,共形成两个(OH),与原来三个(OH)一起,共五个(OH)通过异旋同极吸附作用,与P耦合成P·(OH)5。
整个水合磷酸分子P·(OH)5的次生以太旋涡结构中,五个(OH)以P原子为中心,边自转边围绕P原子以太旋涡的涡流轨道作公转运动,极限偏向状态就如一个五角星形态,并对外界表达出相应次生以太旋涡的振动力场与流动力场形态。

水合磷酸分子以太旋涡存在五个(OH)离子以太旋涡,(OH)虽是碱基,但由于磷原子以太旋涡的牵引,表达出与羟基相类似的酸性现象,是为磷酸。同时(OH)能强化流动力场,五个(OH)流动力场与磷原子以太旋涡流动力场叠加强化后,让水合磷酸分子在细胞的中小分子群里表达出最强的流动力场,其形成的RNA分子长链与大分子团,在细胞中有最广作用范围与最强流动力场,是遗传物质得以非常稳定的核心物质作用基础。其振动力场与流动力场的对比是:
流动力场 >> 振动力场
这种水合磷酸分子的强振动力场与超强流动力场属性判定,可以通过磷酸H3PO4在宏观上的化学属性表现来验证的。象磷酸归属弱酸,一说是中强酸,表达为酸性,是具有强振动力场的体现。磷酸在浓稠时有很强的粘性,不易挥发,不易分解,几乎没有氧化性,都是有很强流动力场的体现,在于强流动力场产生稳定收敛结构,易形成长链磷酸分子耦合结构而让化学性质更稳定。所有具有粘性的宏观流体物质,在微观层次都是强流动力场在产生收敛吸引作用而显象。浓磷酸在空气中容易潮解,说明易形成水合结构,等等。
应磷原子以太旋涡自身的电子连珠现象,—OH的偏向作用,水合磷酸分子以太旋涡除了存在超强流动力场,也存在特定的振动波发散形态与之相应的振动力场,如此是为水合磷酸分子以太旋涡的波流一体形态,让细胞中的水合磷酸分子以太旋涡表达出相应的化学属性,会在后面章节继续介绍这种水合磷酸分子的长链耦合形态,即RNA与DNA。
2、核糖分子
核糖分子是一种单糖,分子式为C5H10O5,是核糖核酸(RNA)的重要组成部分。核糖分子被认为是一种五碳糖,分子中存在环状结构。
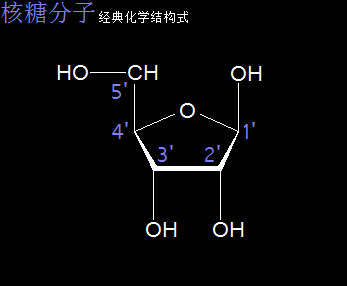
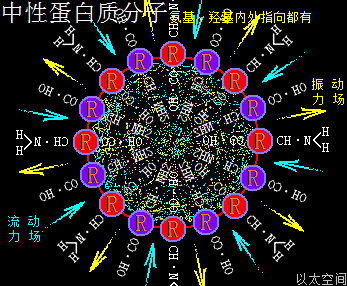
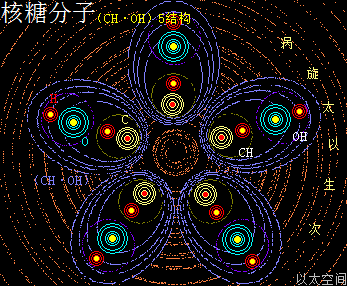
以太旋涡理论下,核糖分子的结构式是(CH·OH)5,即五个C与五个H先分别耦合成五个(CH),及五个O与五个H先耦合成五个(OH),再每个(CH)与(OH)耦合成(CH)·(OH),最后五个(CH)·(OH)耦合成(CH·OH)5。
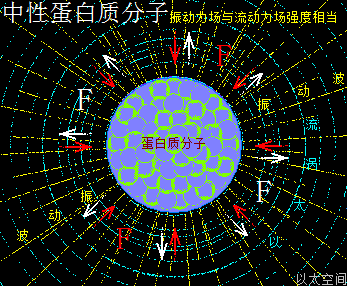
核糖分子是五个(CH·OH)在同一平面上通过范德华力作用耦合在一起及互绕的次生以太旋涡结构,极限偏向状态也如一个五角星形态,并对外界表达出相应次生以太旋涡的振动力场与流动力场形态。
如此多OH、多CH·OH环形结构与运动形态,让核糖次生分子以太旋涡的周边空间存在强流动力场,表达为很强的收敛吸附作用,在宏观上的显象就是有粘性,其它象含糖成分高的各类碳水化合物的水合物,都有很强的粘性,如蜂蜜、米饭、蔗糖浆,等等,都是由于这多OH环形结构强化了流动力场所致。
可以发现核糖分子以太旋涡的空间结构与水合磷酸分子以太旋涡的空间结构有极大的相似性。只是由于核糖中心位置没有大原子量的磷原子结构来强化OH的流动力场,其流动力场强度相对水合磷酸分子以太旋涡的流动力场强度要弱,但其流动力场相对本身的振动力场要强。其以太旋涡空间的振动力场与流动力场对比是:
流动力场 >> 振动力场
同时,由于碳原子以太旋涡的活跃性属于“连珠频率低,偏向小,角动量高”,其以太涡流有极高的平稳性,导致纯粹碳原子之间的耦合结构如金刚石、石墨、富勒烯等的内部结构都有很高的结合强度,而与氢原子以太旋涡耦合成(CH)之后,氢原子成为其“远核外大电子”,强化了碳原子的涡流偏向性,也即提高了碳原子的活跃性,成为“连珠频率低,偏向中,角动量高”的次生以太旋涡,由此也弱化了碳原子之间共价键与范德华力的联结作用,因此其耦合成的核糖形态,即相对氮氧原子等高活跃性原子以太旋涡有比较平稳的空间以太涡流形态,又有原碳原子之间共价键与范德华力弱化后的结合作用特征,让核糖及其它糖类分子可以成为生命组织重要构架成分之一。
3、五种碱基
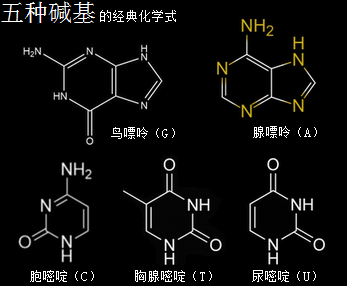
核糖核酸RNA与脱氧核糖核酸DNA,其组成单元分别是核糖核苷酸分子与脱氧核糖核苷酸分子,两种分子各有四种碱基组合形态,共五种碱基类型。所带的不同碱基分别是核糖核苷酸分子由四种碱基,即腺嘌呤(A)、鸟嘌呤(G)、胞嘧啶(C)、尿嘧啶(U)构成的,脱氧核糖核苷酸分子则由四种碱基,即腺嘌呤(A)、鸟嘌呤(G)、胞嘧啶(C)、胸腺嘧啶(T)构成的。这里分别就这五种碱基作一个以太旋涡理论下的模型结构介绍。
——>腺嘌呤(A)
腺嘌呤,就是维生素B4,又称6-氨基嘌呤,化学分子式为C5H5N5,碱基代码为A。
以太旋涡理论下,腺嘌呤的化学结构式为(C·NH)5,即先五个N与五个H耦合成为五个—(NH),再五个C与五个(NH)耦合成五个C·(NH),最后五个C·(NH)耦合成为(C·NH)5。
在腺嘌呤分子以太旋涡中,五个C·(NH)以在同一平面上通过范德华力作用耦合在一起及互绕,极限偏向状态就如一个五角星形态,并在周边空间形成次生以太旋涡,及相应的流场与振动力场。
也可以看出腺嘌呤分子以太旋涡与核糖分子以太旋涡,有几近一样的空间结构形态与运动模式。又由于核糖分子中的碳原子比腺嘌呤分子中的碳原子多一个氢原子,导致核糖分子以太旋涡半径与力场范围比腺嘌呤分子以太旋涡半径与力场范围要来得大一些,但分子结构的稳定性则要差一些。
——>鸟嘌呤(G)
鸟嘌呤的化学分子式为C5H5N5O,碱基代码为G。
以太旋涡理论下,鸟嘌呤的化学结构式为(C·NH)5·O,即先五个N与五个H耦合成为五个(NH),再五个C与五个(NH)耦合成五个C·(NH),及后五个C·(NH)耦合成(C·NH)5,最后(C·NH)5与一个O耦合成(C·NH)5·O。
在鸟嘌呤分子以太旋涡中,五个C·(NH)以O为核心在同一平面上通过范德华力作用耦合在一起及互绕,极限偏向状态就如一个五角星形态,并在周边空间形成次生以太旋涡,及相应的流场与振动力场。
可以看出鸟嘌呤比腺嘌呤在以太旋涡涡心处多一个O原子以太旋涡,其它结构均一致,因此其振动力场与流动力场形态都要强于腺嘌呤。
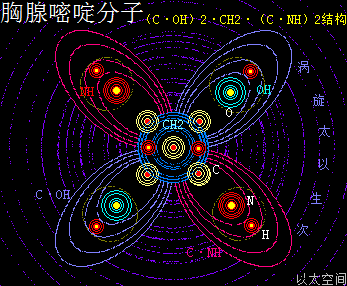
——>胞嘧啶(C)
胞嘧啶,学名为4-氨基-2-羰基嘧啶,化学分子式为C4H5N3O,碱基代码为C。
以太旋涡理论下,胞嘧啶的化学结构式为(C·NH)3·O·CH2,即先三个N与三个H耦合成三个(NH),一个C与二个H耦合成为一个(CH2);再三个C与三个(NH)耦合成为三个C·(NH),及一个(CH2)与一个O耦合成为一个(O·CH2);最后三个C·(NH)与一个(O·CH2)耦合成为(C·NH)3·O·CH2。
在胞嘧啶分子以太旋涡中,一个(O·CH2)与三个C·(NH),在同一平面上通过范德华力作用耦合在一起及互绕,其中(O·CH2)中的O与C通过同旋异极吸附作用耦合在一起,极限偏向状态就如一个正三角星形态,并在周边空间形成次生以太旋涡,及相应的振动力场与流动力场。

——>尿嘧啶(U)
尿嘧啶 ,化学分子式为C4H4N2O2,碱基代码为U,是RNA特有的碱基。
以太旋涡理论下,尿嘧啶的化学结构式为(C·OH)2·(C·NH)2,即先二个O与二个H耦合成为二个(OH),及二个N与二个H耦合成为二个(NH);再二个C与二个OH耦合成为二个C·(OH),及二个C与二个—NH耦合成二个C·(NH);最后是二个C·(OH)与二个C·(NH)耦合成(CH·OH)2·(C·NH)2。
在尿嘧啶分子以太旋涡中,四个离子以太旋涡,即两个C·(OH)与两个C·(NH),在同一平面上通过范德华力作用耦合在一起及互绕,极限偏向状态就如一个十字形态,并在周边空间形成次生以太旋涡,及相应的振动力场与流动力场。
——>胸腺嘧啶(T)
胸腺嘧啶,化学分子式为C5H6N2O2,碱基代码为T。
以太旋涡理论下,其胸腺嘧啶的化学结构式为(C·OH)2·(CH·H)·(C·NH)2,即先二个O与二个H耦合成为二个(OH),二个N与二个H耦合成为二个(NH),及一个C与二个H耦合成为一个(CH)·H;再二个C与二个(OH)耦合成为二个C·(OH),及二个C与二个(NH)耦合成为二个C·(NH);再后二个C·(OH)与二个C·(NH)耦合成(C·OH)2·(C·NH)2;最后是一个(C·OH)2·(C·NH)2与一个(CH)·H耦合成(C·OH)2·(CH·H)·(C·NH)2。
在胸腺嘧啶分子以太旋涡中,四个离子以太旋涡,即两个(C·OH)与两个(C·NH),在同一平面上通过范德华力作用耦合在一起及互绕,(CH·H)在平面的中心,与(C·OH)2·(C·NH)2以同旋异极吸附作用耦合在一起,极限偏向状态就如一个十字形态,并在周边空间形成次生以太旋涡,及相应的流场与振动力场。
由于(CH)·H耦合结构中有两个氢原子在碳原子以太旋涡的涡流轨道上,让(CH)次生以太旋涡的活跃性进一步提高,也即振动力场强化,并且削弱了(CH)次生以太旋涡的流动力场,从而易受外界力场作用而让(CH·H)脱离(C·OH)2·(CH·H)·(C·NH)2耦合结构,化为游离态的(CH)·H与(C·OH)2·(C·NH)2。(CH)·H之中的远碳原子核的氢原子以太旋涡受碳原子的流动力场吸引作用低,也容易脱离涡流轨道,导致(CH)·H易分解成(CH)与H。
(C·OH)2·(C·NH)2即尿嘧啶,可以看出胸腺嘧啶比尿嘧啶在以太旋涡涡心处多一个(CH·H),即CH2,其它结构均一致,于是相比之下胸腺嘧啶有相对较高强度的振动力场与流动力场形态,但结构稳定性相对要差。反之尿嘧啶的结构稳定性要高些,可以在更高环境振动力场中保持原有形态。这也是胸腺嘧啶可以转换为尿嘧啶的物质作用根源,会在后续基因原理章节继续论述两种嘧啶的转换原理。
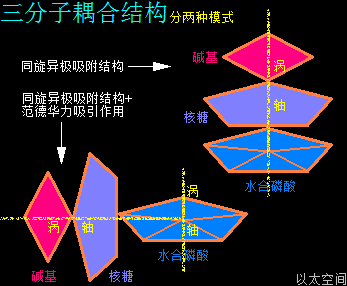
4、三分子耦合结构
水合磷酸分子、核糖分子、碱基分子通过三种分子之间的耦合作用形成整体的核糖核苷酸分子结构。三种分子之间的耦合作用分两种组合模式:
一是同旋异极吸附作用组合,即水合磷酸分子、核糖分子、碱基分子各自的主涡轴重合,涡心在一条直线上,自转方向相同,次生以太旋涡的黄道面相互平行,如宝塔般层层累加,是为水合磷酸—核糖—碱基串连结构下的核糖核苷酸分子。
二是同旋异极吸附作用+范德华力组合,即核糖分子、碱基分子各自的涡轴重合,涡心在一条直线上,自转方向相同,两者的次生以太旋涡的黄道面相互平行,但两者与水合磷酸分子的涡轴相互垂直,再通过范德华力吸引作用,与水合磷酸分子耦合在一起,是为水合磷酸+核糖—碱基的串—并连结构下的核糖核苷酸分子。
这两种耦合模式结构下的核糖核苷酸分子,通过内部的水合磷酸分子间的同旋异极吸附作用,可以继续耦合形成单链型RNA长链、分叉型RNA长链,等等。串连结构下的糖核苷酸分子一般处在RNA分子的中间部分,分子数量相对较多,串—并连结构的核糖核苷酸分子一般在RNA分子的末端,分子相对数量较少。
核糖核苷酸分子的振动力场与流动力场,分别是水合磷酸分子、核糖分子、碱基分子这三种分子的振动力场及流动力场的叠加状态,因此其振动力场与流动力场,都得到很大的强化。两种力场的对比是:
流动力场>>振动力场
由耦合结构的作用机制可知,水合磷酸分子自身,核糖分子自身,碱基分子自身,均会形成相同分子之间的耦合结构,这分别就是长链水合磷酸分子,长链核糖分子,碱基配对结构,会在后面继续描绘。