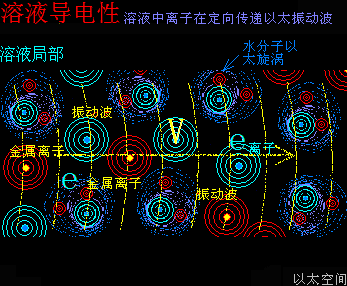
金属盐水溶液或某些酸碱水溶液能导电,是很常见的现象。
虽然经典化学理论通过离子概念来诠释其内在机制,但通过上面离子内涵的重新定性,可知经典化学理论,用多一个电子或少一个电子的离子的存在来说明溶液导电的内在机制是一种错误理论。
比如化学知识中的“纯硫酸是一种极性非常大的液体,其介电系数大约为100。因为它分子与分子之间能够互相质子化对方,造成它极高的导电性,这个过程被称为质子自迁移。发生的过程是:2H2SO4==可逆==H3SO4++ HSO4−”其实是一种错误认识。
硫酸水溶液有导电性虽然是事实,但人们其实从来没有观察与证实这种“H3SO4+、HSO4−”结构的存在,这种结构及所谓的“质子自迁移”描绘只是人们根据错误的经典原子模型及共价电子概念想象出的错误结果。
在“电”章节揭示电其实就是导体内定向传递的以太振动波。电的传递与导体内的原子以太旋涡的振动形态有密切相关。由这个认识可以推导出溶液导电的机制也是一致的,即:
溶液内游离的原子以太旋涡在定向传递以太振动波。
以金属盐溶液为例,金属离子,其实是金属原子以太旋涡在溶液中的游离态。游离态的原子以太旋涡有更高的振动频率,当这种振动频率与电以太振动波相接近时,就能传递这种波。
对于非金属盐溶液,如酸碱溶液来说,则是酸碱分子以太旋涡在与水分子以太旋涡的动态平衡耦合-分离过程中,也会产生高频振动,当这种振动频率与电频率接近时,就表现出导电性。
物理工艺中,一种绝缘体若均匀加入极细金属粉末,会变为导体或半导体,这里只需将溶液中的各游离态原子以太旋涡的分布形态,当成绝缘体中金属分布形态就可简单地明了固体与液体导电性的同一机制。两者主要区别在于溶液的液体态与绝缘体的固体态不同,及作为导电主体的离子态与金属颗粒态的不同。溶液导电性并不是存在所谓的多一个电子或少一个电子离子的结果。