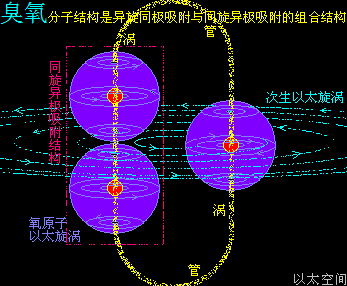
臭氧在经典化学理论中,分子式是O3,与O2、O4、O8互为同素异形体。这里借用臭氧分子O3的结构形态描绘,以给所有气体分子耦合结构形成过程作一个参考,这个分子结构是氧原子O通过同旋异极吸附作用实现的。
氧气O2在以太论里,其构架是两个氧原子以太旋涡通过异旋同极吸附作用耦合后形成的次生以太旋涡。
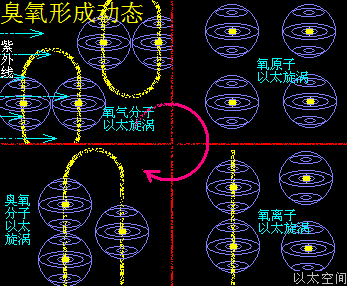
在高空中,空气很稀薄且温度也低,一些相对活跃的氧气O2上升到高空,可以吸收到更多的紫外线作用,紫外线是高能以太纵波,作用在氧气O2上后,导致两个氧原子有更高活跃性,氧原子以太旋涡之间的异旋同极吸附结构被破坏,使氧气O2分解成游离态的氧原子O,两个相同旋转方向的游离态氧原子O通过同旋异极吸附作用结合在一起,形成相对紧密的双氧-O-O-离子结构,如一个“串”字,这个双氧离子再与游离的相反旋转方向的氧原子通过异旋同极吸附作用耦合在一起,形成次生以太旋涡,就是一个臭氧分子O3。
这个过程可用化学式来表达:
O2 + 紫外线 = O + O
O + O = -O-O- + 振动波
-O-O- + O = O3 + 振动波
臭氧分子O3分子结构是异旋同极吸附结构与同旋异极吸附结构的组合形态。不同元素原子之间的这两种吸附结构的组合混杂形态,形成种类繁多的分子结构。
通过臭氧分子结构形成的过程可知,臭氧分子是一种极性分子,是以同旋异极吸附结构的双氧原子“串”形结构为中心,反向旋转的一个氧原子为外围的次生以太旋涡,反向旋转的氧原子角动量不足平衡“串”形结构的双氧原子的角动量,导致次生以太涡流偏向严重,表现为极性。而氧气O2由于双旋涡的对称性,表现为非极性分子。
由于臭氧分子中的反向旋转单原子O与另外两个氧原子-O-O-通过同极涡管相吸,有着比氧气两原子之间更长的涡管,表现为涡管强度相对氧气分子的涡管强度要弱,于是臭氧的稳定性比氧气要差,受外界振动能量作用会自行分解成氧气,这个分解过程是上面描绘的逆过程。
氧气的其它同素异形体如O4、O8都有类似的形成过程及对应的涡管强度,就不再举例描绘。