卤素在元素周期表中,排列在0族惰性气体前一位,有相对高的化学属性,除了被制成化学制品外,也常被用来填充灯泡成为卤素灯泡。这里以卤素灯泡原理的重新解构来认识卤素的特性。
“卤素灯泡(英文:halogen lamp),简称为卤素泡或者卤素灯,又称为钨卤灯泡、石英灯泡,是白炽灯的一个变种。原理是在灯泡内注入碘或溴等卤素气体,在高温下,升华的钨丝与卤素进行化学作用,冷却后的钨会重新凝固在钨丝上,形成平衡的循环,避免钨丝过早断裂。因此卤素灯泡比白炽灯更长寿。”
“卤钨循环:在卤钨灯中,从钨丝蒸发出来的大部分钨和填充的卤素原子或分子,在管壁附近反应,生成挥发性卤化钨,其蒸气浓度较高,因为管壁具有相当高的温度使卤化钨不能附在灯管内壁上,故能防止管壁发黑。卤化钨通过扩散或对流,从管壁附近向灯丝方向扩散,部分卤化钨在灯丝的高温区被分解成卤素和钨。分解出来的钨吸附在灯丝表面,卤素则与蒸发出来的钨反应。”
这个原理描绘是存在一个问题的:冷却后的钨为何会重新凝固在钨丝上,而不是凝固在灯泡内壁?要知道按这个原理描绘,钨丝与卤素进行化学作用,其作用后的“钨-卤”化合分子是分布在整个灯泡空间的,当断电后整个灯泡会冷却,管壁的温度很快就会降到常温,“管壁具有相当高的温度使卤化钨不能附在灯管内壁上”的作用机制就会失效--姑且当这个作用机制成立。于是就没有什么物质作用机制导致其冷却后化合分子中的钨原子重新回到灯泡中心的钨丝位置。
正常的理解是灯泡冷却后化合分子中的钨原子游离出来,必是沉淀在整个灯泡内部空间的各个表面,包括灯泡内壁与钨丝表面,而灯泡内壁的面积要远远大于钨丝表面积,于是灯泡内壁的钨原子会最大量沉积,结果钨丝很快就会被消耗光,表现为钨丝断掉与灯泡损坏,但实际情况是钨丝很稳定。理论拓展与实际现象冲突,表明这个原理是错误的,根源是在错误化学理论下的错误推导。
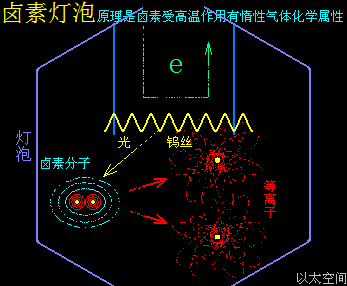
那如何用以太论下的化学原子耦合结构来解释这一卤素灯泡原理?
卤素排列在0族惰性气体前一位,表明的是卤素原子的活跃性只比惰性气体的活跃性低一级,而高于排位于更前的其它元素原子。如此活跃性排位带来的结果是卤素有很高的化学活跃性,但又没有过高后带来的惰性气体在常温下就有的等离子形态。当卤素被填充在灯泡里,在钨丝的高温高热作用下,卤素原子的活跃性再被提高一个层次,达到惰性气体的原子活跃性层次,除了成为等离子外,还表现出惰性气体常温下的化学作用属性:不能被其它原子捕获产生耦合结构,这里是不能被钨原子捕获。而这种活跃性又抑制了钨丝在高温下的升华作用,就如高气压下液体的沸点会升高,于是钨丝的结构形态不容易被破坏,表现为灯泡寿命相对长。
这个卤素灯泡原理的解构与重新认识,通过说明卤族元素被高温加热后,元素原子有更强角动量,各自分离成为等离子,具有惰性气体的属性,不被钨原子所吸引形成耦合结构,来表达互为临近的元素之间,在不同温度环境下,具有趋向临近元素原子化学属性的行为。以这里的卤素为例,用一条约等式来表达就是:
极高温卤素原子化学属性≈常温惰性气体原子化学属性
或
极低温惰性气体原子化学属性≈常温卤素原子化学属性
也即,惰性气体可以衰减成临近的卤族元素,而卤族元素升高温后,随着原子活跃性的提升,化学属性被升温过程还原成同阶的惰性气体。
这一作用模式可以推广到整个元素周期表的其它元素转换形态,比如氮,升到极高温后有类似常温氧的化学属性,降到极低温后成固体后,有类似常温碳的化学属性;又比如磷,升到极高温后有类似常温硫的化学属性,降到极低温后有类似常温硅的化学属性;而氧,升到极高温后有类似常温氟的化学属性,氟,升到极高温后有类似常温氖的化学属性,等等。
由这里描绘可知,元素周期表的各元素原子,会应外界的温度不同,会表达出与临近排位的其它元素原子相类似的化学属性。自然这种类似化学属性只是极端条件如温度、压强条件的另类表现,并非常温常压下的实验观测。
如此描绘下的元素周期表各元素原子,会应不同环境条件而相互转变化学属性,并不是人们观念中的如元素周期表排列的一成不变的化学作用形态。一般是高序列原子向低序列原子转变,这是一个原子以太旋涡的角动量耗散与衰变过程,也是一个时刻都在进行的过程,也可因温度升高而暂时表现同阶更高序列原子作用形态。西方化学理论,则以固化呆板地看待各元素原子在元素周期表中的位置,不能有机的联系不同原子之间的关系。