苯是一种石油化工基本原料,苯具有的环系叫苯环,分子式为C6H6。据说是德国的化学家凯库勒因为对苯的结构式未搞清楚而非常烦恼,后来在一个晚上梦见了一幅蛇咬自己尾巴的图,进而发现了苯环的结构。这一发现过程被化学界传为美谈。
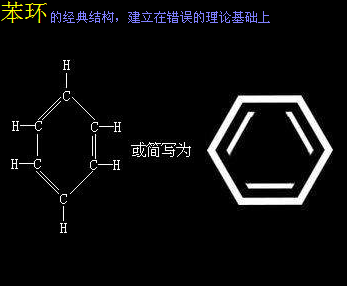
后来人们引入电子云概念,并通过实验“表明,苯不能使溴水或酸性KMnO4褪色,这说明苯中没有碳碳双键。研究证明,苯环主链上的碳原子之间并不是由以往所认识的单键和双键排列(凯库勒提出),每两个碳原子之间的键均相同,是由一个既非双键也非单键的键(大π键)连接。”由此否定苯环的单键双键交替形态的结构。
化学界解释不了苯环的“每两个碳原子之间的键均相同”的内在电子云运行机制。这是因为苯环-电子云模型本就是一个错误的模型。这个模型建立的基础,也即电子云概念,是一个被否定的概念,苯环-电子云模型就可以被抛弃。但苯环的某些结构描绘可以保留,比如,苯环去掉一个氢原子以后的结构叫苯基,6个碳原子处于一个平面上,形成一个闭合的正六边环状结构。
这里用以太旋涡理论来构建一种全新的、更符合实验观察的苯环结构:
碳原子通过同旋异极吸附作用,可以形成碳原子链,再借助范德华力,进而形成各种高熔点、高沸点的碳的同素异形体如金刚石、石墨、富勒烯等。苯基,就是6个碳原子闭合结构。虽然6个碳原子可以通过首尾相接的同旋异极吸附作用形成一个碳环,但首尾相接带来的碳环有最紧密的联结作用,会如石墨一般稳定,石墨的层片状结构就是这一形态,与苯在化学反应中表现的活跃性相差很大,因此这一结构模式不是苯环的正确结构。
有另一种结构是6个碳原子,分三对,每两个碳原子在同一面通过异旋同极吸附作用形成共价键,而在另一面,每两个碳原子也在同一面通过异旋同极吸附作用形成共价键,但每个碳原子,不是只与一个碳原子形成异旋同极吸附结构,而是与两个碳原子在两个面分别形成异旋同极吸附结构。如图示,给6个碳原子分别编号为A、B、C、D、E、F。

在正面,A与B形成异旋同极吸附结构,C与D形成异旋同极吸附结构,E与F形成异旋同极吸附结构。
在反面,B与C形成异旋同极吸附结构,D与E形成异旋同极吸附结构,F与A形成异旋同极吸附结构。
最后,A、B、C、D、E、F之间再通过范德华力相互吸引并收缩整体空间,形成稳定环状结构。
如此异旋同极吸附结构成一个正六边形碳环,是“每两个碳原子之间的键均相同,是由一个既非双键也非单键的键连接”,与实验观察的结果是一致的,并带来苯环有相对弱的结构联结强度,及氢原子在轨道上的的偏向作用,在整体上通过次生以太旋涡参与化学反应。