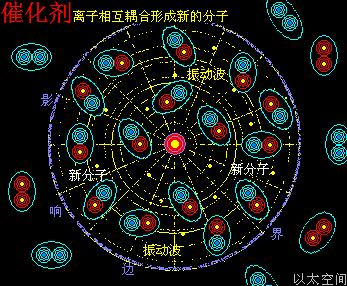
催化剂是化学工业的一大类,故作一个小节专门说明其作用机制。
在化学反应里能改变反应物化学反应速率(提高或降低)而不改变化学平衡,且本身的质量和化学性质在化学反应前后都没有发生改变的物质叫催化剂。一般来说,催化剂是指参与化学反应中间历程的,又能选择性地改变化学反应速率,而其本身的数量和化学性质在反应前后基本保持不变的物质。
在经典化学理论中,化学反应的一般公式是:A+B=C+D。催化剂参与化学反应的一般公式是:
A+催化剂=X,B+X=C+D+催化剂
也即催化剂参与化合反应,生成中间产物X,同时改变化学反应速率,但最终被还原。
在现实化学实验中,化学家只是根据一种反应现象的前后产物来验证分子的不同,从而推导出化学公式,但无法验证这个化学过程中分子的实际结合或分离过程的。催化剂能改变化学反应速率,是很直观的现象,但催化剂参与化学反应生成中间产物并最终被还原这一描绘,则完全是化学家猜想的结果,而非确定的实验事实!
也即,没有什么实验证明中间化学反应及中间产物的存在,化学家只是根据化学反应的一般公式A+B=C+D,及催化剂又实实在在能改变速率,却又能保持反应前后不增不减,来推导出催化剂在化学反应存在“A+催化剂=X,及B+X=C+D+催化剂”这么一个过程。中间产物X是一种猜想,是为了给催化剂在化学公式中一个合理位置而想象出来的,而不是化学公式中必须存在一个中间产物。

同时,“催化剂参与化学反应生成中间产物”的说法,与某些物质作为催化剂时表现出的超高稳定性是相冲突的,比如金属铂,俗称白金,是化学、石油和化工反应过程经常采用的一种催化剂,但金属铂的稳定性是非常高的,在实验中一般只有强酸强碱能溶化,那么在非强酸强碱环境下的石油、化工生产条件下,如此稳定的铂又是如何与分子生成中间产物的呢?
另外,在化学反应公式中,存在分子数量匹对的原则,即1摩尔分子对应另1(或2、3)摩尔分子产生化学反应,可考查的常见无机化学反应公式里,这种对应的比率一般在1:1-1:5之间。比如2H2+O2=2H2O,是1:2,即1个O2对应2个H2,C+O2=CO2,是1:1,即1个C对应1个O2,等等。但是在化学反应通常加入少量或微量的催化剂,就能极大地加快化学反应的速率,是个可观察的实验现象,催化剂与反应分子的数量比率在实验中可达1:1000000。
“催化剂参与化学反应生成中间产物”的说法,带来的问题是如此少量微量的催化剂,在面对巨量的反应物双方分子里,这是如何实现速率的改变的?若按“A+催化剂=X,B+X=C+D+催化剂”这条猜想公式来理解,及摩尔分子对应量,那么在数量比率是1:1000000的情况下,这个中间产物要反复出现1000000次,然后才消失,这个高频反复的中间产物的结合与分离过程,显然只会拖累反应速度,而不是加快反应速度。是什么机制导致这个中间产物如此高频率出现并消失,却又能加快化学反应速率的?这个悖论是这条猜想公式无法解释的。
催化剂的稳定性及催化剂与反应双方剂量的悬殊差别,表明的是“催化剂参与化学反应生成中间产物”这个说法其实是不正确的。那另外答案是什么?这里用以太旋涡理论来描述催化剂的参与化学反应的另一种模式。
原子是微观以太旋涡,分子是多原子以太旋涡相互耦合后的空间结构,而电子绕核及连珠运动导致原子以太旋涡存在涡流偏向作用,表现为振动,从而导致原子周边空间存在以太波动,表现为可见光或红外紫外辐射等等,由此分子周边空间也存在以太波动,应分子的种类不同,其周边空间的以太波动的强度尺度也不同,这是基本认识。
催化剂,就是这么一种周边空间以太波动相对结合双方化学分子的以太波动强度尺度,过大或过小的分子结构形态。过大表现为提高反应速率,过小表现为减缓反应速率。要理解这一判定,可用温度对化学速度的影响来类比。
温度,原子热运动提高的宏观现象,在原子以太旋涡周边空间里,则表现为以太波动的强度与尺度的分布形态。升温能加速冰块溶化或橡胶变软,也能加速化学反应,这些现象都很直观。升温,在以太空间上,其实就是强化了以太波动的强度与尺度,从而让参与反应的双方化学分子,有更强的克服范德华力的能力,及反应分子内部的原子有更弱的共价键结合形态,从而加快原分子分裂过程与新分子的耦合过程,降温则反之。
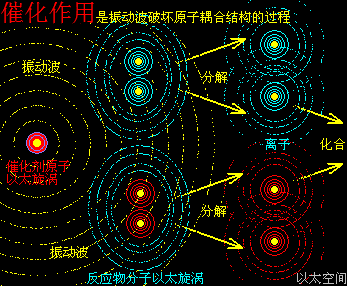
催化剂,有着与升温或降温相同的功效,只是不表现出宏观热、冷这些可检测的感官特征,而是在催化剂原子周边空间表现为提高或降低以太波动强度与尺度,促进或减慢反应物分子以太旋涡的分解过程,从而改变这空间里的化学反应的速度,这是催化剂的作用实质。
催化剂的这个促进速度作用,也与电解反应很类似:都是高频波破坏与削弱原子耦合结构,从而加速化学反应的进程。而催化剂本身,如电解反应中的两个石墨电极一样稳定,不与反应物分子组合形成新的物质分子结构,即经典公式里的X是不存在的。
催化剂的这个促进或减慢速度作用也与水只参与溶解作用的许多化学反应相类似:水分子破坏与削弱反应物原子耦合结构,让反应物溶解后,双方分子加速化学反应,而水前后并不增减,比如Ca(OH)2+Na2CO3=CaCO3+2NaOH,若只将一堆氢氧化钙与一堆碳酸钠粉末混合,则几无化学反应,而只需在混合粉末中加入几滴水,化学反应瞬间发生。而生活中用水来灭水,则是水减慢化学反应的一个一般例子,火被水浇灭,其实是水减慢乃至中止燃烧物与氧气的化学反应过程,这些有水参与但前后不增不减的化学反应由于太常见了,让人意识不到水在其中起到的是一种催化作用。
以加速化学反应的催化剂为例,假设化学反应双方分子的空间尺度是1个单元体积,催化剂原子以太旋涡振动的空间影响范围是100个单元距离,那么催化剂的空间影响范围是1000000个单元体积(体积是距离的三次方)。
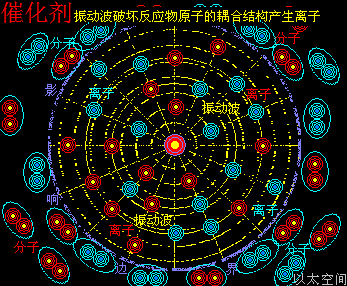
当催化剂混入化学反应双方的分子群里,催化剂原子以太旋涡振动瞬间提高周边空间1000000个单元体积内的以太波动强度,所有分布在这个空间里的反应物分子的耦合结构强度都被以太波动所削弱,加速共价键的断裂,也即耦合结构解体,致使各反应物分子以太旋涡分解成游离态的以太旋涡,也即离子,新生的双方反应物离子相互耦合,有更高强度的共价键结合形态及耦合结构,从而不被催化剂的振动作用与以太波动所破坏,于是能稳定存在于催化剂环境里。期间催化剂原子是不与反应物双方分子产生化学反应,不存在中间产物X。
催化剂的这种作用实质新认识,就没有如铂作为催化剂的稳定性与其中间产物之间的矛盾,也没有催化剂的剂量微小与反应物分子数量巨大之间导致的速率悖论。
催化剂的这种作用,其实也与太阳光照射下导致温度升高,导致植物加速生长的效果几近一致,可作一个类比:
太阳--催化剂原子以太旋涡
太阳光--催化剂原子以太旋涡振动波
地球表面空间气温升高--催化剂周边空间以太波动提升
植物细胞加速生长--反应物加速化合反应
减慢化学反应速度的催化剂催化原理是一致的,只是作用过程相反,即吸收催化剂周边以太波动而减慢分子以太旋涡的解体速度,类似于冰晶吸热降温,这里就不继续描绘。
催化剂这种全新认识,也可以来解说激素、酶对生命体的作用,或银离子(以太旋涡)的杀菌功效,也是激素、酶分子的以太波动对生命细胞分子、营养物分子的耦合结构的影响,甚至可以来解说癌症成因,会在《广义时空论附录(中)·生命意志篇》中描述。